詳解癌-睪抗原
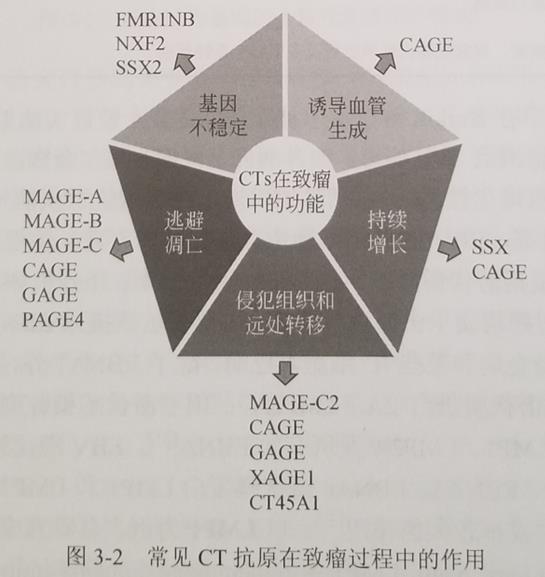
癌-睪抗原(cancer testis antigen,CT)是一類能在多種腫瘤組織中表達,而睪丸、胎盤和胎兒卵巢以外的正常組織幾乎不表達的抗原。因其表達的獨特性,癌-睪抗原被認為是一類能用于腫瘤免疫治療的理想靶抗原,至今已鑒定出250多個CT抗原成員(數(shù)據(jù)來源I http://www.cta.lncc.br)。不同的CT抗原在至瘤過程中發(fā)揮著不同的作用(圖3-2)。目前臨床研究較多的是黑色素瘤抗原-1 (melanoma-associated antigen gene,MAGE-1)和 NY-ES0-1。
20世紀90年代初,van der Bruggen等成功克隆了第一個人類腫瘤抗原,并且命名為MAGE-1,成為腫瘤免疫學發(fā)展史上的里程碑。所有的MAGE基因產(chǎn)物在中心部位均含有mage同源結構域(mage homology domain,MHD),其為由165-171個氨基酸構成的高度保守序列。基于這些基因的組織特異性表達,MAGE家族被分為兩大類:MAGE- I類抗原和MAGE- II類抗原。MAGE- I家族成員,包括MAGE-A、MAGE-B和MAGE-C 3個亞系,除在睪丸和胎盤組織中表達外,在其他正常組織中均不表達,而在多種腫瘤組織中呈高表達狀態(tài)。但是,MAGE-II類抗原在正常成熟組織有表達,其中最有代表性的為 MAGE-D和MAGE-G。因此,MAGE-I類抗原被認為是一種腫瘤特異性抗原,在腫瘤免疫研究領域受到極大關注。
MAGE-1不僅表達于黑色素瘤,還表達于肺癌、乳腺癌、食管癌、口腔鱗狀細胞癌、尿道上皮癌等。實驗證明,一些表觀遺傳學機制如DNA甲基化和組蛋白乙酰化,在調(diào)節(jié)MAGE-1基因表達上起到了重要作用。有一些研究表明,在HCT116人類結腸癌細胞中,敲除DNA甲基轉移酶DNMT1和DNMT3b后,MAGE-A1啟動子的甲基化明顯減少。另外,小鼠體內(nèi)研究表明,基因組低甲基化能促進腫瘤形成,同時也證明mage-1的表達與腫瘤的發(fā)生發(fā)展相關。目前MAGE-A1/HLA-A1和MAGE-A11/HLA-A1的人源T 細胞受體Fab片段已被成功制備,逆轉錄這兩種Fab片段進入T細胞,可使T細胞特異性識別腫瘤細胞,提高抗腫瘤作用。
NY-ESO-1是由Chen等使用重組cDNA文庫血清學分析技術從食管癌cDNA表達文庫中篩出來的一種腫瘤共享抗原。該抗原涉及各個系統(tǒng)的腫瘤,表達頻率不一,其中蛋白表達頻率最高的是神經(jīng)母細胞瘤(82%)、滑膜肉瘤(80%)、惡性黑色素瘤(46%),而mRNA在前列腺癌、膀胱癌、乳腺癌,多發(fā)性骨髓瘤和肝細胞癌中有較高表達,在口腔鱗癌、食管癌的表達也能達到20%40%。
Jager等最早鑒別出一組位于NY-ESO-1氨基酸序列第157-170位的表位多肽 (p157-167,p157-165, p155-163),這些多肽可被HLA-A2分子提呈,從而誘導出特異性 的CTL應答。目前研究人員已鑒定出余種NY-SO-1抗原表位,可被不同類型的HLA 分子提呈。隨著越來越多的表位多肽的發(fā)現(xiàn),各種多肽疫苗也逐漸問世。自抗原肽疫苗應用以來,國內(nèi)外關于NY-ESO-1疫苗在腫瘤免疫治療中的臨床試驗報道不斷,從多肽疫苗到全長蛋白疫苗,均取得了—定效果。日本本學者將NY-ESO-1 p157-170與不完全弗氏佐劑(incomplete freund’s adjuvant, IFA)聯(lián)合使用作為疫苗,結果發(fā)現(xiàn)該疫苗可誘導多數(shù)患者產(chǎn)生體液免疫和T細胞反應,部分患者在接種后1年仍可檢測出反應性T細胞。可見,通過佐劑與抗原肽的聯(lián)合應用,能有效增強抗原肽的免疫原性。Schuberth等研究發(fā)現(xiàn),在骨髓瘤小鼠模型中,回輸靶向NY-ESO-1的嵌合抗原受體改造的T細胞,可特異性的殺傷內(nèi)源性表達NY-ESO-1的腫瘤細胞。Robbins等研發(fā)的靶向NY-ESO-1的TCR-T療法先后用于轉移性黑色素瘤和滑液細胞瘤患者,治療反應率分別為55% (11/20)和61% (11/18), 這些結果均證實經(jīng)基因改造靶向NY-ESO-1的T細胞具有—定的治療效果。
-
最新內(nèi)容

